Anken
– Dãy đồng đẳng anken (olefin): Công thức tổng quát CnH2n ( n ≥ 2).
Đồng phân anken
– Cấu trúc tổng quát: CnH2n (n ≥ 2).
Bạn đang xem: Công thức Anken
– Anken có đồng phân mạch C, đồng phân vị trí nối đôi và đồng phân hình học.
– Cách tính nhanh đồng phân anken:
Tìm 2 nguyên tử C có cặp liên kết đôi, mỗi C sẽ chứa 2 nhóm thế khác nhau hoặc giống nhau.
Ví dụ với C4H8: Không tính nguyên tử C có liên kết đôi, còn lại có 2 nguyên tử C và 8 nguyên tử H nhóm thế.

Nếu yêu cầu tính đồng phân cấu tạo, có 3 đồng phân. Nếu tính cả đồng phân hình học, sẽ có 4 đồng phân.
Ví dụ với C5H10: Không tính nguyên tử C có liên kết đôi, còn lại có 3 nguyên tử C và 10 nguyên tử H nhóm thế.
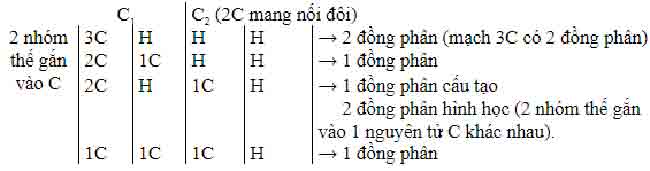
+ Đồng phân cấu tạo:
Cách viết đồng phân: Viết mạch C thẳng. Tìm đối xứng để đặt liên kết đôi. Có thể tạo các đồng phân mạch thẳng.
Giảm 1 nguyên tử C để tạo nhánh, tìm đối xứng để gắn C nhánh và liên kết đôi. Kiểm tra hoá trị C. Khi số C nhánh bằng số C trong mạch chính thì dừng.
Thêm nguyên tử H để hoàn thành đồng phân.
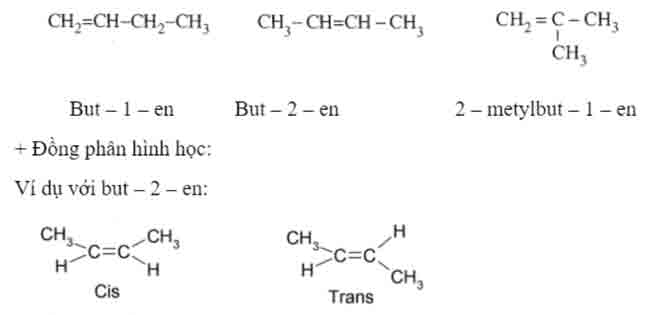
Khi có 2 nhóm thế khác nhau trên nguyên tử C có liên kết đôi, sẽ có đồng phân hình học. Nếu các nhóm thế ( -CH3, -C2H5, -Cl,…) có phân tử khối lớn hơn cùng nằm về cùng một phía với liên kết đôi, được gọi là dạng cis, khác phía được gọi là dạng trans.
Danh pháp
+ Chọn mạch chính: là mạch dài nhất, chứa liên kết đôi, có nhiều nhánh nhất.
Xem thêm : ✅ CÔNG THỨC HÓA 10 ⭐️⭐️⭐️⭐️⭐️
+ Đánh số: từ phía gần liên kết đôi nhất.
+ Tên: Số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính – số chỉ vị trí liên kết đôi – en.
– Đặc điểm cấu tạo: Phân tử có một liên kết đôi, trong đó có một liên kết π và một liên kết σ.
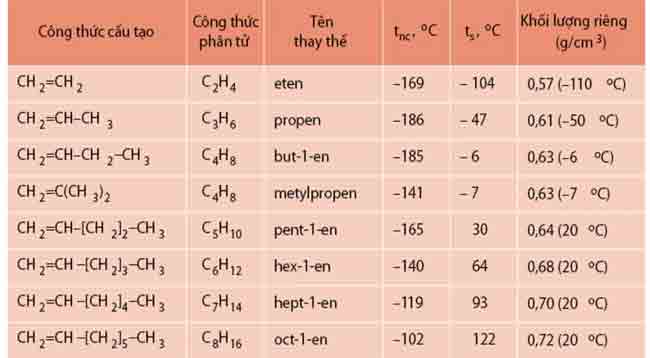
Tính chất vật lí
+ Nhẹ hơn nước, không hòa tan trong nước.
+ Các anken từ C2 đến C4 là khí, từ C5 trở đi là chất lỏng hoặc rắn.
+ Khi khối lượng phân tử tăng, nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng tăng dần.
Ở điều kiện thường, các anken từ C2H4 đến C4H8 là chất khí; từ C5H10 trở đi là chất lỏng hoặc rắn.
Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các anken tăng dần theo chiều tăng của khối lượng phân tử.
Các anken nhẹ hơn nước (D < 1 g/cm3) và không hòa tan trong nước.
Tính chất hoá học của anken
+ Phản ứng đặc biệt là phản ứng cộng (vì liên kết π kém bền, dễ bị phá vỡ):

a. Phản ứng cộng hiđro
Anken cộng H2 sinh ra ankan tương ứng; cộng với halogen hay hợp chất halogen sinh ra dẫn xuất halogen; cộng với nước sinh ra ancol tương ứng.
b. Phản ứng cộng halogen
Thí nghiệm: Đưa từ từ khí etilen vào dung dịch brom, thấy màu của dung dịch nhạt dần.
Rót dung dịch brom vào chất lỏng anken, thấy màu của dung dịch brom mất đi.
Xem thêm : ✅ Công thức nguyên hàm ⭐️⭐️⭐️⭐️⭐️
Các đồng đẳng của etilen đều làm mất màu dung dịch brom.
c. Phản ứng cộng HX (X là OH, Cl, Br,…)
Các anken cũng tham gia phản ứng cộng với nước, với hiđro halogenua (HCl, HBr, HI), với các axit mạnh.
Các anken có cấu trúc phân tử không đối xứng khi tác dụng với HX có thể tạo ra hỗn hợp hai sản phẩm.
Quy tắc Markovnikov: Khi cộng hợp chất không đối xứng HX (HCl, HBr, H2O), H ưu tiên gắn vào cacbon bậc thấp, còn X ưu tiên gắn vào cacbon bậc cao.
Quy tắc cộng Markovnikov (1838-1904): Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H (hoặc phần mang điện tích dương) thường cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn), còn nguyên tử hoặc nhóm nguyên tử X (phần mang điện tích âm) cộng vào nguyên tử cacbon bậc cao hơn (có ít H hơn).
+ Phản ứng trùng hợp:

Phản ứng oxi hóa
a. Phản ứng oxi hóa hoàn toàn
Khi đốt etilen và các đồng đẳng, chúng cháy và tạo ra nhiều nhiệt lượng.
b. Phản ứng oxi hóa không hoàn toàn
Thí nghiệm: Đưa từ từ khí etilen vào dung dịch KMnO4, thấy màu của dung dịch nhạt dần và xuất hiện kết tủa nâu đen của MnO2.
Các đồng đẳng của etilen cũng làm mất màu dung dịch KMnO4. Phản ứng này được sử dụng để phân biệt anken và ankan.

Điều chế



– Ứng dụng:
Các anken và dẫn xuất của anken được sử dụng làm nguyên liệu trong nhiều quy trình sản xuất hóa học. Etilen, propilen, butilen được sử dụng cho tổng hợp các polime có nhiều ứng dụng.




Nguồn: https://vatlytuoitre.com
Danh mục: Định luật
