Công thức cấu tạo và tính chất hóa học của axit acetic C2H4O2
Tính chất vật lý của axit acetic C2H4O2
– Axit acetic CH3COOH là một chất lỏng trong suốt, không màu, có vị chua và hoàn toàn hòa tan trong nước. Dung dịch axit acetic với nồng độ từ 2 – 5% được sử dụng làm giấm ăn.
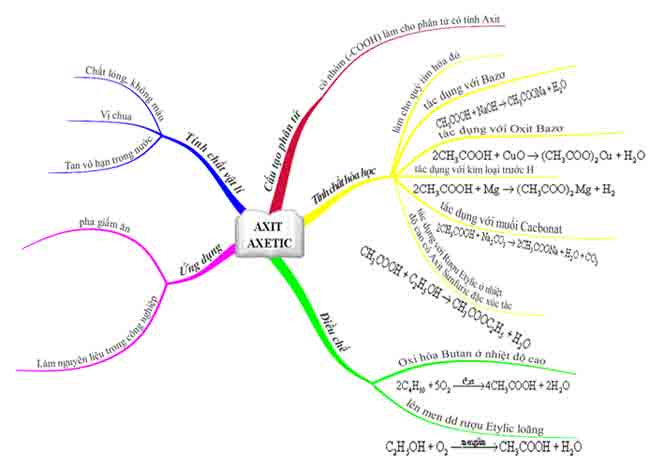
II. Công thức cấu tạo của axit acetic CH3COOH
* Công thức cấu tạo của axit acetic:
Bạn đang xem: ✅ Công thức axit axetic ⭐️⭐️⭐️⭐️⭐
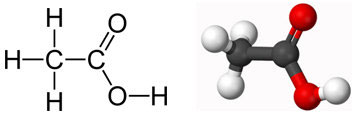
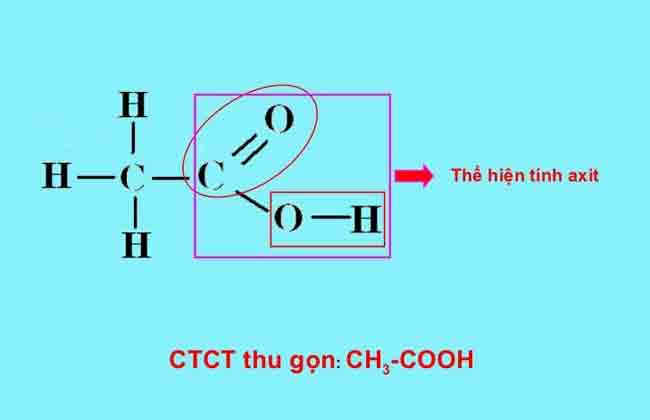
* Công thức viết gọn: CH3COOH
– Một nhóm -OH được liên kết với nhóm C=O tạo thành nhóm -COOH, và chính nhóm -COOH (Cacboxyl) làm cho phân tử có tính axit.
III. Tính chất hóa học của axit acetic CH3COOH
– Axit acetic là một axit yếu, yếu hơn các axit HCl, H2SO4, HNO3, H2SO3 nhưng mạnh hơn axit cacbonic H2CO3. Axit acetic cũng có đầy đủ tính chất của một axit.
1. Dung dịch axit acetic làm quỳ tím đổi màu thành đỏ.
2. Axit acetic tác dụng với bazơ oxit, bazơ tạo thành muối và nước.
Xem thêm : ✅ Công thức tính diện tích hình tròn ⭐️⭐️⭐️⭐️⭐️
CH3COOH + NaOH → CH3COONa + H2O
– CH3COONa: (Natri axetat)
CH3COOH + CaO → (CH3COO)2Ca + H2O
3. Axit acetic tác dụng với kim loại (trước H) giải phóng H2:
2CH3COOH + 2Na → 2CH3COONa + H2↑
4. Axit acetic tác dụng với muối của axit yếu hơn.
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O.
5. Axit acetic tác dụng với rượu tạo ra este và nước (xúc tác là H2SO4 đặc, nóng):
CH3COOH + HO-C2H5 CH3COOC2H5 + H2O.
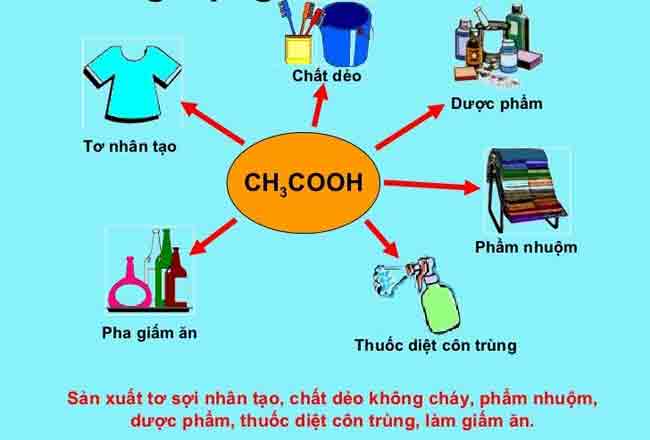
IV. Ứng dụng của axit acetic.
Hơn 60% axit acetic CH3COOH được sử dụng trong sản xuất các polyme tổng hợp từ vinyl axetat hoặc xenlulozo este. Các vinyl axetat phần lớn được sử dụng trong công nghiệp sơn, giấy bọc và nhựa như plastic.
Dẫn xuất của axit acetic được sử dụng rộng rãi như:
- Aluminum axetat: Al(OH)2CO2CH3 là chất thuốc nhuộm vải.
- Muối amon axetat CH3CO2NH4 được sử dụng để sản xuất axetamid- một chất dung môi, giúp lợi tiểu và toát mồ hôi trong y học.
- Muối kali được sử dụng trong công nghiệp sơn.
- Metyl axetat được sử dụng làm dung môi cho xenlulozo nitrat, este và các hợp chất khác.
- N-butyl axetat được sử dụng làm dung môi trong công nghiệp sơn và gốm sứ.
- Axit phenylacetic được sử dụng trong công nghiệp nước hoa và tổng hợp penicillin.


Dung dịch axit acetic loãng được sử dụng trong các phòng thí nghiệm lâm sàng để thực hiện các thí nghiệm liên quan đến hồng cầu và bạch cầu.
– Axit acetic có nhiều ứng dụng trong đời sống và công nghiệp:
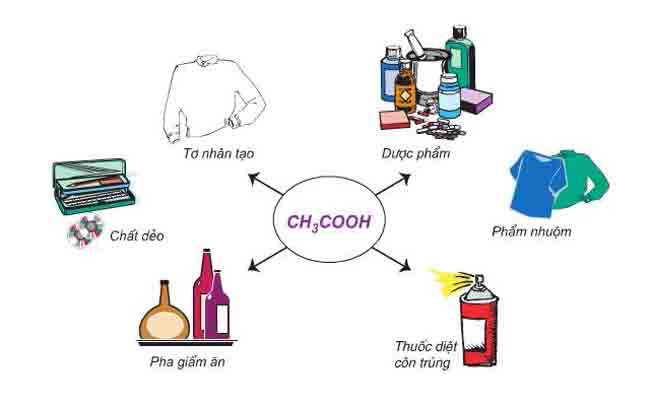
- Giấm ăn
- Sản xuất chất dẻo
- Ứng dụng trong công nghiệp dệt nhuộm, thuốc diệt côn trùng
- Sản xuất tơ nhân tạo
- Sản xuất este
- Ứng dụng trong dược phẩm
V. Điều chế axit acetic.
4.1. Cacbonyl hóa methanol
Methanol tác dụng với cacbon monoxit tạo thành axit acetic:
CH3OH + CO → CH3COOH
Quá trình liên quan đến chất trung gian iodometan, xúc tác là phức chất kim loại có 3 bước sau:
CH3OH + HI → CH3I + H2O
CH3I + CO → CH3COI
CH3COI + H2O → CH3COOH + HI
4.2. Oxy hóa axetaldehyt
Trong công nghiệp, axit acetic CH3COOH được sản xuất từ butan C4H10 với sự có mặt của xúc tác và nhiệt độ
2C4H10 + 3O2 → 4CH3COOH+ 2H2O
4.3. Phương pháp lên men trong điều kiện hiếu khí
4.3.1. Phương pháp lên men chậm
Đổ axit acetic CH3COOH vào một thùng gỗ sồi có thể tích 250- 300l, để trống 1/5 thể tích, sau đó đổ thêm nước ép nho vào cho đến khi đạt ½ thùng.
Tiến hành quá trình lên men ở nhiệt độ phòng. Quá trình kéo dài vài tuần. Kiểm tra nồng độ rượu còn 0,3- 0,5% thì lấy giấm ra, bổ sung thêm dinh dưỡng mới vì nếu để lâu, chất lượng giấm sẽ giảm.
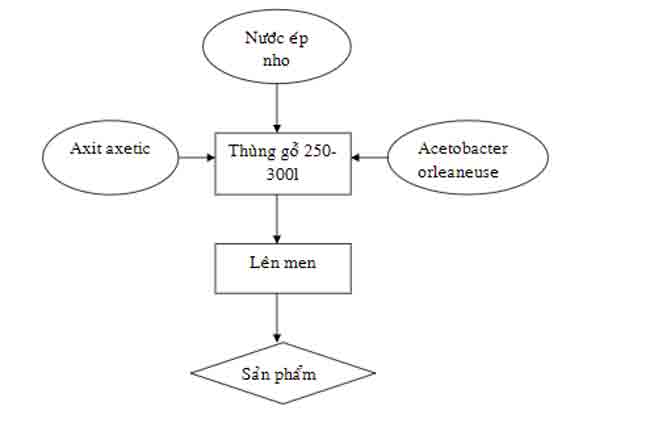
4.3.2. Phương pháp lên men nhanh
Cho dung dịch axit acetic nồng độ 3- 5% chảy qua lớp phoi bào (lõi bắp) để thanh trùng và axit hóa chất mang để kích thích vi khuẩn dễ phát triển.
Sử dụng nước vô trùng để rửa qua và nhập vi khuẩn axetic.
Cho dòng môi trường từ trên xuống qua hệ thống phân phối đồng thời thổi khí từ dưới lên.
Vi khuẩn sẽ oxy hóa rượu thành axit acetic CH3COOH, thẩm thấu qua màng tế bào ra ngoài, chảy xuống đáy thiết bị.
Quá trình kéo dài từ 8- 10 ngày ở nhiệt độ 24- 37oC.
4.3.3. Phương pháp lên men chìm
Cho dung dịch lên men vào thiết bị và thổi khí mạnh vào.
Thể huyền phù và dung dịch lên men được tạo ra.
4.3.4. Phương pháp kết hợp
Hệ thống lên men bao gồm:
- Lớp trên cùng là lớp đệm chứa vi sinh vật
- Lớp giữa là một thùng chứa dung dịch sau khi lên men chảy xuống
- Tầng dưới đáy là hệ thống thổi khí
Hàm lượng axit acetic có trong dung dịch lên men thường không cao, khoảng 5-10% và thường lẫn với các chất khác, vì vậy, dung dịch sau quá trình lên men chỉ có thể sử dụng để chế biến thực phẩm.
Để nâng hàm lượng axit acetic CH3COOH cũng như làm sạch các tạp chất, người ta sử dụng phương pháp chưng cất.
Sản xuất axit acetic
Axit acetic (CH3COOH) được sản xuất theo 2 phương pháp chính là sinh học và tổng hợp. Trong đó, phương pháp sinh học chỉ chiếm khoảng 10% sản lượng. Dưới đây là một số phương pháp sản xuất axit acetic.
– Lên men oxi hóa từ rượu etylic:
C2H5OH + O2 → CH3COOH + H2O
– Lên men kỵ khí từ đường:
C6H12O6 → 3CH3COOH
– Cacbonyl hóa metanol:
CH3OH + O2 → CH3COOH
– Oxi hóa axetaldehyt:
2CH3CHO + O2 → 2CH3COOH
Và nhiều phương pháp khác…
Axit acetic là gì?
Axit acetic là một hợp chất hữu cơ có tính axit mạnh, chúng có công thức hóa học CH3CO2H (cũng viết là CH3COOH). Đây là loại hóa chất đã được sản xuất từ rất lâu và được ứng dụng rất nhiều trong công nghiệp, sản xuất thực phẩm và y học…
Chúng còn được biết đến với nhiều tên gọi khác nhau như: etanoic, Hydro axetat (HAc), Ethylic acid, Axit metanecarboxylic, dấm, acetic acid, Acid ethanoic…
Tác hại của axit acetic – CH3COOH
- Khi hít phải một lượng lớn axit acetic sẽ gây kích ứng mũi, cổ họng và phổi. Điều này có thể gây tổn hại nghiêm trọng cho các mô niêm mạc của cơ quan hô hấp và dẫn đến khó thở.
- Nếu nuốt phải axit này, có thể gây ăn mòn nghiêm trọng ở miệng và hệ tiêu hóa, gây nôn mửa, tiêu chảy, rối loạn tuần hoàn, suy thận và thậm chí có thể gây tử vong.
- Tiếp xúc với da có thể gây kích ứng và viêm, hoặc trong trường hợp nặng có thể gây bỏng ngay sau khi tiếp xúc.
Lưu ý khi sử dụng và bảo quản axit acetic – CH3COOH
7.1 Lưu ý khi sử dụng axit acetic
- Hãy đeo đồ bảo hộ như găng tay, mũ, quần áo dài khi sử dụng axit acetic.
- Đeo thiết bị hô hấp phù hợp nếu xử lý axit acetic trong một khu vực không có khí thòa hợp.
- Nếu tiếp xúc với da hoặc mắt, hãy rửa ngay lập tức. Hãy đảm bảo rằng có nước sạch để rửa mắt gần khu vực làm việc.
7.2 Cách bảo quản axit acetic như thế nào?
- Axit acetic cần được lưu trữ trong kho có mái che, ở nhiệt độ phù hợp và có thông gió.
- Tránh để axit acetic ở nơi có nhiệt độ quá cao và tránh xa nguồn nhiệt, lửa hoặc tia lửa.
Bài tập về axit acetic
* Bài 2 trang 143 sách giáo trình hoá 9: Trong các chất sau đây:
a) C2H5OH. b) CH3COOH.
c) CH3CH2CH2OH. d) CH3CH2COOH.
Chất nào tác dụng được với Na, NaOH, Mg, CaO? Viết các phương trình hóa học.
° Lời giải bài 2 trang 143 sách giáo trình hoá 9:
– Chất tác dụng được với Na là: a, b, c, d (do có gốc OH).
– Chất tác dụng được với NaOH là: b, d (do có gốc COOH).
– Chất tác dụng được với Mg là: b, d (do có gốc COOH).
– Chất tác dụng được với CaO là: b, d (do có gốc COOH).
* Phương trình phản ứng:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
2CH3COOH + 2Na → 2CH3COONa + H2↑
2C3H7OH + 2Na → 2C3H7ONa + H2↑
2C2H5COOH + 2Na → 2C2H5COONa + H2↑
Xem thêm : ✅ Công thức tính diện tích hình tròn ⭐️⭐️⭐️⭐️⭐️
CH3COOH + NaOH → CH3COONa + H2O
C2H5COOH + NaOH → C2H5COONa + H2O
2CH3COOH + Mg → (CH3COO)2Mg + H2↑
2C2H5COOH + Mg → (C2H5COO)2Mg + H2↑
2CH3COOH + CaO → (CH3COO)2Ca + H2O
2C2H5COOH + CaO → (C2H5COO)2Ca + H2O
* Bài 5 trang 143 sách giáo trình hoá 9: Axit acetic có thể tác dụng được với những chất nào trong các chất sau đây: ZnO, Na2SO4, KOH, Na2CO3, Cu, Fe? Viết các phương trình hóa học xảy ra (nếu có).
° Lời giải bài 5 trang 143 sách giáo trình hoá 9:
– Các chất tác dụng được với axit acetic là ZnO, KOH, Na2CO3, Fe.
– Phương trình hóa học phản ứng:
2CH3COOH + ZnO → (CH3COO)2Zn + H2O.
CH3COOH + KOH → CH3COOK + H2O.
2CH3COOH + Na2CO3 → 2CH3COONa + CO2↑ + H2O.
2CH3COOH + Fe → (CH3COO)2Fe + H2↑.
* Bài 7 trang 143 sách giáo trình hoá 9: Cho 60 gam CH3-COOH tác dụng với 100g CH3-CH2-OH thu được 55gam CH3-COO-CH2-CH3
a) Viết phương trình hóa học xảy ra và gọi tên của phản ứng.
b) Tính hiệu suất của phản ứng trên
° Lời giải bài 7 trang 143 sách giáo trình hoá 9:
– Theo bài ra ta có:
nCH3COOH = 60/60 = 1 mol;
nC2H5OH = 100/46 = 2,17 mol.
a) Phương trình phản ứng:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
– Phản ứng này gọi là phản ứng este hóa.
b) Hiệu suất của phản ứng:
– Theo phương trình phản ứng trên và số liệu đề bài cho thì số mol rượu dư, do đó tính hiệu suất phản ứng theo CH3COOH.
– Theo lý thuyết, 1 mol CH3COOH (60g) tạo ra 1 mol CH3COOC2H5 (88g) nhưng thực tế chỉ thu được 55g.
⇒ Vậy hiệu suất của phản ứng là: H% = (55/88).100% ≈ 62,5%.
* Bài 8 trang 143 sách giáo trình hoá 9: Cho dung dịch axit acetic nồng độ a% tác dụng vừa đủ với dung dịch NaOH nồng độ 10% thu được dung dịch muối có nồng độ 10,25%. Hãy tính a.
° Lời giải bài 8 trang 143 sách giáo trình hoá 9:
– Gọi khối lượng dung dịch CH3COOH và NaOH cần dùng là m và m’:
⇒ mCH3COOH = C%. mdd = (m.a)/100 ⇒ nCH3COOH = (m.a)/(100.60)= (m.a)/6000 (mol).
– Tương tự: mNaOH = (m’.10)/100 = m’/10 ⇒ nNaOH = m’/400 (mol).
– Phương trình phản ứng:
Xem thêm : ✅ Công thức tính diện tích hình tròn ⭐️⭐️⭐️⭐️⭐️
CH3COOH + NaOH → CH3COONa + H2O
– Theo phương trình phản ứng trên:
nCH3COOH = nNaOH
Do đó ta có: (m.a)/6000 = m’/400 ⇒ a = (15.m’)/m.
mCH3COONa = (82.m’)/400 (g)
mdd sau pư = m + m’ (g)
Theo đề bài ta có: C% (CH3COONa) = ((82.m’)/400)/(m + m’) = 10,25/100.
Giải ra ta có m = m’. Thay vào a = (15.m’)/m ⇒ a = 15.
⇒ Nồng độ dung dịch axit là 15%
Giải bài tập về axit acetic
Câu 1. Hãy điền vào các chỗ trống:
a) Axit acetic là chất …… không màu, có vị …… và hòa tan …… trong nước.
b) Axit acetic được sử dụng để sản xuất ……
c) Dung dịch giấm ăn có nồng độ từ 2 đến 5%.
d) Bằng cách …… butan với chất xúc tác thích hợp, ta thu được ……
Bài làm:
a) lỏng – chua – hoàn toàn trong nước
b) dược phẩm, phẩm nhuộm, chất dẻo và polymer polyvinyl
c) axit acetic có nồng độ
d) oxi hóa – axit acetic
Câu 2. Trong các chất sau đây:
a) C2H5OH
b) CH3COOH
c) CH3CH2CH2OH
d) CH3CH2COOH
Chất nào tác dụng được với Na, NaOH, Mg, CaO? Viết các PTHH.
Bài làm:
Xem thêm : ✅ Công thức axit glutamic ⭐️⭐️⭐️⭐️⭐
– Tác dụng với Na:
2C2H5OH + 2Na → 2C2H5ONa + H2 ↑
2CH3COOH + 2Na → 2CH3COONa + H2 ↑
2CH3CH2CH2OH + 2Na → 2CH3CH2CH2ONa + H2 ↑
2CH3CH2COOH + 2Na → 2CH3CH2COONa + H2 ↑
– Tác dụng với NaOH:
Xem thêm : ✅ Công thức tính diện tích hình tròn ⭐️⭐️⭐️⭐️⭐️
CH3COOH + NaOH → CH3COONa + H2O
CH3CH2COOH + NaOH → CH3CH2COONa + H2O
– Tác dụng với Mg:
2CH3COOH + Mg → (CH3COO)2Mg + H2 ↑
2CH3CH2COOH + Mg → (CH3CH2COO)2Mg + H2 ↑
– Tác dụng với CaO:
2CH3COOH + CaO → (CH3COO)2Ca + H2O
2CH3CH2COOH + CaO → (CH3CH2COO)2Ca + H2O
Câu 3. Axit acetic có tính axit do trong phân tử có:
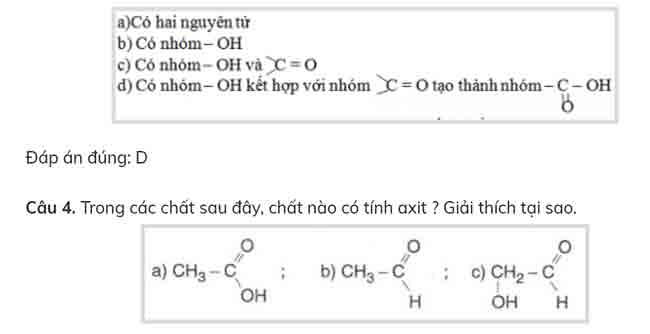
Bài làm:
Chất a có tính axit do trong phân tử chất có nhóm -COOH.
Câu 5. Axit acetic có thể tác dụng với những chất nào trong các chất sau đây: ZnO, Na2SO4, KOH, Na2CO3, Cu, Fe?
Viết các PTHH xảy ra nếu có.
Bài làm:
Axit acetic tác dụng với các chất: ZnO, KOH, Na2CO3, Fe.
Phương trình phản ứng xảy ra:
2CH3COOH + ZnO → (CH3COO)2Zn + 2H2O
CH3COOH + KOH → CH3COOK + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 ↑ + 2H2O
2CH3COOH + Fe → (CH3COO)2Fe + 2H2 ↑
Câu 6. Hãy viết PTHH điều chế axit acetic từ:
a) natri axetat và axit sunfuric.
b) rượu etylic.
Bài làm:
a) Điều chế CH3COOH từ natri axetat và axit sunfuric:
2CH3COONa + H2SO4 → 2CH3COOH + Na2SO4
b) Điều chế CH3COOH từ rượu etylic:
CH3CH2OH + O2 (lên men) → CH3COOH + H2O
Câu 7. Cho 60 g CH3COOH tác dụng với 100 g CH3CH2OH thu được 55 g CH3COOC2H5.
a) Viết PTHH và gọi tên sản phẩm của phản ứng.
b) Tính hiệu suất của phản ứng trên.
Bài làm:
a) Phương trình hóa học:
CH3COOH + CH3CH2OH ⇔ CH3COOC2H5 (etyl axetat)
b) Ta có:
- nCH3COOH = 60 / 60 = 1 (mol)
- nCH3CH2OH = 100 / 46 = 2,17 (mol)
Theo PTHH, ta có:
- nCH3COOH = nCH3CH2OH = nCH3COOC2H5 = 1 mol
Khối lượng CH3COOC2H5 thu được theo lý thuyết là:
mCH3COOC2H5 = 1 x 88 = 88 g
Hiệu suất của phản ứng là:
H = (55 / 88) x 100% ≈ 62,5%
Câu 8. Cho dung dịch axit acetic nồng độ a % tác dụng vừa đủ với dung dịch NaOH nồng độ 10% thu được dung dịch muối có nồng độ 10,25%. Hãy tính a.
Bài làm:
Ta có phương trình hóa học của phản ứng:
Xem thêm : ✅ Công thức tính diện tích hình tròn ⭐️⭐️⭐️⭐️⭐️
CH3COOH + NaOH → CH3COONa + H2O
Gọi m (g) và m’ (g) lần lượt là khối lượng của CH3COOH và NaOH. Ta có:
nCH3COOH = (m x a) / (100 x 60) = ma/6000
nNaOH = (m’ x 10) / (100 x 40) = m’/400
Theo PTHH, ta có:
nCH3COOH = nNaOH
⇔ ma/6000 = m’/400 (*)
⇔ a = 15m’/m
nCH3COONa = nNaOH = m’/400
⇔ mCH3COONa = (m’/400) x 82
Mặc dù nồng độ muối thu được theo lý thuyết là ≈ 10,26%, ta lấy nồng độ là ≈ 10,25% cho độ chính xác. Giải ra ta có m = m’.
Thay m = m’ vào (*), ta được a = 15.
Vậy nồng độ của dung dịch CH3COOH là 15%.
Nguồn: https://vatlytuoitre.com
Danh mục: Định luật
